Química Orgânica:
A Química Orgânica é um ramo da química que estuda os elementos compostos por Carbono e outros elementos organógenos.
-Elementos Organógenos: São geradores de substâncias orgânicas e SEMPRE contém o Carbono. Além do carbono, podem estar contidos também H, O, N, S, P e alguns elementos da família 7ª, ou seja, F, Cl, Br, I. Para memorizar, é bom lembrar:
C H O N S P X, no qual X engloba os elementos da família 7ª citados.
O.B.S.: Quando começaram os estudos sobre a química orgânica, existia uma teoria na qual os elementos orgânicos precisavam de vida para serem produzidos, porém, hoje sabe-se que essa teoria está comprovadamente errada, portanto: Os elementos orgânicos podem ser gerados a partir de elementos INORGÂNICOS.
-Postulados sobre o Carbono:
1°: O Carbono, nos compostos orgânicos é SEMPRE TETRAVALENTE, ou seja, excerce 4 ligações, já que pertençe à família 4ª, e portanto precisa fazer 4 ligações para permaneçer estável
2°: As quatro valências do carbono são iguais. (não entendi muito bem).
3°: Os Carbonos constantemente encadeiam-se, formando as cadeias carbônicas.
4°: Os átomos de carbono podem se ligar por uma, duas ou três valências, ou seja, ligação monovalente, bivalente ou trivalente
Ou seja, como podemos ver, o Carbono não exerce 4 ligações de uma vez, ele as divide deste modo sempre.
Ligações Carbônicas:
Quando forma suas substâncias, o carbono sempre ocupa um certo modelo espacial. Nesse modelo, seus átomos são formados sempre por tetraedros regulares, nos quais os quatro vértices, correspondem às suas 4 valências e o carbono ocupa o centro do polígono. As ligações nem sempre são representadas pela sua forma espacial. Elas podem ser representadas também pela forma estrutural e pela molecular, as quais já conheçemos. Na formula estrutural, existem diversas maneiras de se representar a ligação, que serão estudadas mais adiante.
Forma Espacial
xistem TRÊS tipos de ligação carbônica:
-Ligação Simples:
Na qual os tetraedros do carbono se ligam por um vértice:
-Ligação Dupla:
Na qual os tetraedros se unem por dois vértices, ou seja, uma aresta:
-Ligação Tripla:
Na qual os tetraedros se unem por três vértices, ou seja, uma face:
Características Gerais:
Os compostos orgânicos formados APENAS por hidrogênios e carbonos possuem moléculas APOLARES, ou seja, suas cargas elétricas se anulam. Porém, quando algum outro elemento orgânico faz parte da molécula (ONSP X), essa molécula passa a ter polaridade.
Cadeias Carbônicas:
Quando os átomos de carbono se unem, eles formam cadeias, denominadas cadeias carbônicas. Essa cadeias dão origem a diversos compostos orgânicos. As cadeias carbônicas, no entanto, podem possuir todos os outros elementos organógenos além de carbono.
Carbono Primário: É o carbono que está ligado diretamente a apenas UM carbono, ele está sempre presente nas extremidades das cadeias (se estiver ligado a um carbono). Podem porém estar também no meio das cadeias, se estiverem ligados a APENAS um carbono.
Esses carbonos não estão nas estremidades mas estão ambos ligados a apenas UM átomo de Carbono
Nessa imagem, todos os carbonos das estremidades são primários, pois estão ligados a apenas UM carbono, o do meio.
Carbono Secundário: É um carbono que está ligado DIRETAMENTE a apenas DOIS carbonos.
Todos os caronos dessa cadeia são secundários, pois ligam-se diretamente a apenas dois carbonos.
Carbono Terciário: é um carbono que se liga DIRETAMENTE a apenas TRÊS carbonos.
Como, já vimos, os carbonos das extremidades são primários, porém, o do centro é terciário, pois liga-se diretamente aos três carbonos.
Carbono Quaternário: É o carbono que se liga DIRETAMENTE a QUATRO carbonos. Ele possui o número máximo de ligações, já que o carbono satura-se com 4 delas. Ou seja, não existe carbono 5ário (não sei qual é a palavra).
O carbono do centro é quaternário, pois ele se liga a 4 carbonos diretamente.
OBS.: O fato de um carbono ter ligações duplas ou triplas, não muda o fato de ele ser primário, secundário ou terciário. Essa condição não se aplica porém ao carbono quaternário, que para ser quaternário só pode ter ligações simples, senão ele ficaria com mais de 4 átomos na camada de valência e isso não seria possível.
Obs. Quanto à representação das cadeias:
Isso são cadeias carbônicas. Em cada vértice e em cada extremidade há um carbono, há não ser que esteja escrito o nome de outro átomo. Se não houver nada escrito, significa que lá existem carbonos. É necessário ver se o carbono está saturado, ou seja, se está ligado a quatro elementos. Se ele não estiver saturado, como no caso dos vértices da primeira cadeia, é necessário acrescentar a ele o número de hidrogênios necessários para formar 4 ligações, como foi feito em sua extremidade.
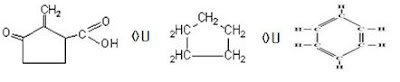
Anel Benzênico:
O anel benzênico é um caso particular de cadeia carbonica e pode ser representado dessas diferentes maneiras, porém significam a mesma coisa. Esse tipo de cadeia possui sempre formato HEXAGONAL e ligações ALTERNADAS em PRIMÁRIAS e SECUNDÁRIAS. No caso da primeira figura, elas não estão representadas, mas o círculo no centro indica que isso é um anel benzênico, então deve-se concluir que elas estão presentes e representá-las se necessário para seu entendimento. Lembre-se que é necessário completar o carbonos com hidrogênios se eles não estiverem executando 4 ligações, como está representado na terceira cadeia.
Classificação das Cadeias Carbônicas:
Cadeia Saturada:
É a cadeia que não apresenta ligações duplas ou triplas, apenas ligações simples.
Cadeia Insaturada:
É a cadeia que apresenta ligações duplas ou triplas. Ela pode também ter ligações simples, mas se uma delas for dupla ou tripla, a cadeia se torna insaturada.
Essa cadeia possui, em sua maioria, ligações simples, mas pelo fato de possuir apenas uma ligação dupla, ela se tornou insaturada.
Cadeia Aberta ou Acíclica:
São cadeias que não são fechadas (como o anel benzênico), ou seja, apresentam NO MÍNIMO duas extremidades e não possuem NENHUM ciclo ou anel.
Essa cadeia tem mais de duas extremidades, porém, continua sendo aberta, pois não possui ciclos ou anéis
Cadeia Fechada ou Cíclica:
São cadeias que não apresentam extremidades e formam ciclos ou anéis benzênicos
Cadeia Mista ou Cíclica Ramificada:
São cadeias que apresentam regiões fechadas (ciclos, anéis) e regiões abertas.
Cadeia Normal, Reta ou Linear:
São cadeias que apresentam APENAS DUAS extremidades, e seus átomos estão dispostos numa única sequência.
Essas linhas saindo dos carbonos não contam como extremidades, pois estão representando a ligação dos carbonos com hidrogênios. As extremidades são portanto os carbonos presentes nas pontas, direita e esquerda.
Cadeia Ramificada ou Arborescente:
São cadeias que apresentam no MÍNIMO TRÊS extremidades e possuem átomos não dispostos numa única sequência, ou seja, são mais irregulares.
Cadeia Aromática:
As cadeias aromáticas são uma subdivisão das cadeias fechadas. Para ser aromática, uma cadeia precisa ser formada APENAS por anéis benzênicos. Elas podem ter uma pequena ligação entre elas, como no primeiro exemplo, ou podem ser coladas umas nas outras, como no segundo exemplo. A classificação desses dois casos virá adiante.
Cadeia Não-Aromática ou Alicíclica:
São cadeias fechadas, ou cíclicas, porém, que não apresentam o anel benzênico, que pode também ser chamado de núcleo aromático portanto.
Cadeia Heterogênea:
São cadeias que possuem Heteroátomos.
-Heteroátomo: Se a cadeia carbônica possui um átomo que é diferente de C, ENTRE dois (ou mais) átomos de C, esse será um heteroátomo, ou seja, ele interrompe, se intromete entre dois (ou mais) carbonos. Porém, se esse átomo diferente de C estiver presente na cadeia, mas não se intrometendo entre átomos de C ele não será um heteroátomo.
O átomo de O é um heteroátomo
Cadeia Homogênea:
São cadeias que não possuem Heteroátomos. Podendo possuir como citado acima, outros átomos além de C, porém, eles não podem estar interferindo entre dois ou mais carbonos.
A parte pontilhada indica a parte na qual não há outros átomos além de C, porém a cadeia continua sendo homogênea, pois o átomo de N não se intromete entre carbonos.
Classificação das Cadeias Fechadas:
Mononuclear:
As cadeias Mononucleares apresentam um único ciclo ou anel.
Polinuclear:
As cadeias Polinucleares apresentam pelo menos dois agrupamentos cíclicos, que podem ser formados por apenas ciclos, apenas anéis ou ambos.
Essas cadeias, são subdivididas em dois grupos:
-Polinuclear Isolada: São cadeias nas quais os ciclos ou anéias, não se encontram grudados, mas sum separados por uma ligação.
-Polinuclear Condensada/Acumulada: São cadeias que apresentam pelo menos um átomo comum a dois ciclos ou anéis, ou seja, pelo menos dois ciclos ou anéis devem estar grudados, ou condensados.
Resumo:
Química Geral e Cálculo:
Unidade de MassA Atômica (u):
A unidade de massa atômica foi criada para medir a massa atômica de um átomo, uma substância(formada por moléculas) ou de algum elemento químico (diversos isótopos, ou seja, átomos do mesmo elemento, mas com massas diferentes), já que é impossível usar uma unidade de medida como a grama para dimensionar um átomo, pois eles são muito pequenos.
A unidade de massa atômica, se baseia no isótopo mais conhecido do carbono, que seria o ¹²C. Ele possui justamente uma massa de 12 unidades de massa atômica, ou seja, 12 u e a massa atômica de todos os átomos, elementos químicos ou substâncias, baseia-se em uma parte dessa massa, ou seja 1/12.
OBS.: É MUITO importante saber que 1u, corresponde a aproximadamente 1,66 . 10-24, portanto se você tiver a massa atômica de algum elemento, átomo ou substância e desejar saber quanto ela PESA, deverá multiplicá-la por 1,66 . 10-24
Ex.
A massa atômica de uma molécula de nicotina é 162 u. Quanto ela pesa?
162 . 1,66 . 10-24
1,62 . 10² . 1,66 . 10-24
2,68 . 10-22
Portanto uma molécula de nicotina tem massa 162 u e pesa 2,68 . 10-22.
Massa Atômica de um Átomo:
A massa atômica de um átomo baseia-se então na unidade de massa atômica u. Então se dissermos que a massa atômica do Nitrogênio é 14 u, significa que ela corresponde a 14 vezes 1/12 da massa do ¹²C, ou seja, 14 vezes 1 u, como foi citado acima. A massa atômica de um átomo é abreviada por MA, principalmente nas fórmulas e nos problemas de cálculo.
Massa Atômica de um Elemento:
A maioria dos elementos químicos são constituídos por uma mistura de isótopos.
Para determinar a massa atômica de um elemento, como o cloro por exemplo, devemos calcular sua média ponderada, que seria a soma dos números de massa de cada elemento, multiplicados por suas respectivas ocorrências na substância (25%, 76%, 2%, etc.), dividida por 100, veja no exemplo:
O cloro é constituído por uma mistura de dois isótopos, de massas atômicas, respectivamente, 35 e 37 e ocorrência 75% e 25%.
• 17Cℓ35......... 25%
Então, concluímos que a massa atômica do elemento Cloro é 35,5 u, ou seja, cada um de seus átomos pesa 35,5 u, então com a massa atômica de um elemento podemos descobrir a massa atômica de um átomo.
A abreviação da massa atômica de um elemento é também MA.
Massa Molecular:
A massa molecular, define a massa de um molécula. Para descobrirmos qual é essa massa, precisamos saber quantos átomos de cada elemento existem na molécula e quais são suas respectivas massas atômicas. Devemos então multiplicar o número de átomos de cada elemento por sua respectiva massa atômica e somar os resultados. A massa molecular é abreviada como MM, isso será importante na hora de resolver problemas de cálculo.
Ex.:
(Massas Atômicas: H = 1 u; O = 16 u)
H2O = 2 . 1 + 16 . 1
H2O =2 + 16
H2O = 18 u
MM = 18 u
Mol:
Mol foi uma unidade de medida criada para saber a grandeza de uma quantidade de matéria. Ele pode ser usado para medir átomos, moléculas, íons ou qualquer outra coisa.
A medida do mol define-se pela quantidade de substância, átomo ou elemento, que contém tantas entidades quanto os átomos de ¹²C, contidos em 0,012 kg (ou 12 gramas) de ¹²C . Porém, em 12 gramas de ¹²C, existem 6,02 . 10²³ átomos, portanto um Mol tem sempre 6,02 . 10²³ entidades, podendo elas serem moléculas, átomos, etc.
Essa constante de medida do Mol chama-se constante de Avogadro.
OBS.: Para transformar u em gramas, foi visto que devemos multiplicar o número de u por 1,66 . 10-24, mas para transformar GRAMAS EM U, devemos multiplicar o peso em gramas pela constante de Avogadro, ou seja 6,02 . 10²³
Massa Molar:
Massa Molar é a massa que contém 6,02 . 10²³ entidades de uma substância, elemento, átomos etc. Ela corresponde ao número de entidades, tomado em gramas, e é portanto representada em g/mol.
É extremamente importante não confundir Massa Molecular (MM), com Massa Molar, que é abreviada apenas por M, pois as duas são coisas completamente distintas.
Ex.:
Mercúrio (Hg) MA = 201 u
201g
-Contém 6,02 . 10²³ átomos de mercúrio, que constituem 1 mol de Hg.
A massa molar de Hg é 201g/Mol.
Portanto, concluímos que a Massa Molar é o número da massa atômica, tomado em gramas e dividido por 1 mol, ou seja g/mol.
Outros exemplos:
H2O a MM = 18 u
M = 18,0 g/mol a corresponde a 6,02.1023 moléculas de H2O.
1 mol de moléculas de H2O pesam 18,0 g e contém 6,02.1023 moléculas de H2O.
NaCℓa MF = 58,5 u
M = 58,5 g/mol a corresponde a 6,02.1023 fórmulas de NaCℓ.
1 mol de de fórmulas de NaCℓ pesam 58,5 g e contém 6,02.1023 fórmulas de NaCℓ.
SO42- a MI = 96 u
M = 96,0 g/mol a corresponde a 6,02.1023 ânions de SO42-.
1 mol de ânions de SO42- pesam 96,0 g e contém 6,02.1023 ânions de SO42-.
Concluímos a partir desses exemplos que o Mol e a Massa molar, não são utilizados somente com átomos, mas com diversos outros elementos, moléculas, fórmular, etc, como foi citado acima.
Número de Mol:
Se soubermos a massa de um elemento, átomo, molécula, etc.; em gramas e sua Massa molar (M), podemos descobrir seu número de mols pela seguinte fórmula:
n (número de mols) = massa/Massa Molar
n = m/M
n = m/M mol


























Casinos in New York - TheJTM Hub
ResponderExcluirFind the best Casinos 강원도 출장마사지 in New York. 김제 출장마사지 In a small 화성 출장안마 town known for its casino and entertainment, the Casinos in 🎰 Games: 550+💰 Min 세종특별자치 출장샵 Deposit: $10🎲 Games: 200+🤵 Live Dealer: 110+ 문경 출장안마
How To Make Money On Sports Betting
ResponderExcluirOnline sports gri-go.com betting is available for a whole host of US and European sports betting หารายได้เสริม markets. Some US septcasino.com states, poormansguidetocasinogambling.com like Louisiana https://jancasino.com/review/merit-casino/ and New Jersey, allow